Tóm Tắt Lý Thuyết Hóa Hữu Cơ 11, Lý Thuyết Hóa Học 11 Theo Chuyên Đề Và Dạng
Hóa hữu cơ là 1 phần kiến thức vô cùng rộng. Để tìm hiểu rõ hơn về hóa hữu cơ, hãy cùng VUIHOC tìm hiểu về bí quyết phân loại, hotline tên, công thức hóa học, các thành phần liên kết, đồng đẳng, đồng phân và các loại hidrocacbon qua bài viết sau.
1. Khái niệm hóa hữu cơ
Hợp chất hữu cơ là các hợp hóa học của cacbon (trừ các hợp chất dễ dàng và đơn giản như CO, CO2, HCN, những muối cacbonat, muối hạt xianua hay muối cacbua,…).
Hóa học hữu cơ là ngành hóa học nghiên cứu và phân tích về những hợp chất hữu cơ.
Bạn đang xem: Lý thuyết hóa hữu cơ 11
- Đặc điểm cấu tạo:
Bắt phải chứa nguyên tử Cacbon (C) trong nguyên tố của hợp hóa học hữu cơ. Các nguyên tử C links với nhau và liên kết với các nguyên tử khác, hay là cùng với Hidro (H), kế tiếp đến Oxy (O), Nito (N), một vài hợp chất cất cả lưu huỳnh (S) và Photpho (P),…
Liên kết hóa học trong các hợp chất hữu cơ đa số là link cộng hóa trị.Các làm phản ứng thường diễn ra chậm với không xẩy ra hoàn toàn, không diễn ra theo 1 hướng nhất định.Số lượng các hợp hóa học hữu cơ lên tới khoảng 10 triệu chất, nhiều hơn thế hẳn so với số lượng các chất vô cơ chỉ có tầm khoảng 100.000 chất.
- đặc điểm vật lý:
Dễ bay hơi, nhiệt độ nóng chảy và nhiệt độ sôi thấp, kém bền với sức nóng độ, dễ cháy rộng so với các hợp chất vô cơ.
Đa số các hợp chất hữu cơ không tan trong nước dẫu vậy tan nhiều trong các dung môi hữu cơ.
- đặc điểm hóa học :
Hầu hết các phản ứng thường diễn ra chậm ko xảy ra hoàn toàn và ra mắt theo nhiều khunh hướng khác nhau, tạo thành hỗn hợp các sản phẩm.
2. Phân các loại và gọi tên các hợp chất hữu cơ
2.1. Phân loại những hợp hóa học hữu cơ
Hợp hóa học hữu cơ thường xuyên được tạo thành 2 loại:
- Hiđrocacbon: vào phân tử chỉ đựng hai yếu tắc là C cùng H. Hiđrocacbon lại được tạo thành các nhóm nhỏ.
Hiđrocacbon no: chỉ có những liên kết đối kháng (CH4, C2H6,…)
Hiđrocacbon ko no: có cả những liên kết solo và link đôi, links ba (C2H4, C2H2,…)
Hiđrocacbon thơm: gồm vòng benzen vào phân tử (C6H6, C7H8,…).
- Dẫn xuất của hidrocacbon: vào phân tử ngoài các nguyên tố C cùng H thì còn chứa các nguyên tố khác ví như O, N, Cl, S, P,…
Dẫn xuất halogen: CH3Cl, C6H5Br,…
Ancol: CH3OH, C2H5OH,…
Axit: CH3COOH,...
Anđehit: HCHO, CH3CHO,…
Phenol: C6H5OH,…
Xeton: CH3COCH3,…
Este: CH3COOC2H5,…
Ete: CH3CH2OCH2CH3,…
Phân loại theo mô hình mạch Cacbon:
- Mạch hở: những nguyên tố hóa học kết cấu nên mạch sinh hoạt dạng thẳng hoặc không đóng góp thành vòng khép kín.
Mạch thẳng: cấu tạo mạch sinh hoạt dạng thẳng.
Mạch nhánh: kết cấu mạch tất cả phân nhánh.
- Mạch vòng: các nguyên tố hóa học kết cấu nên mạch đóng vòng lại thành dạng vòng khép kín.
Đồng vòng: các nguyên tử Cacbon đóng vòng lại tạo thành vòng khép kín.
Dị vòng: Vòng khép kín đáo được tạo thành từ các nguyên tử C và có sự tham gia của các nguyên tử của thành phần hóa học khác như O, N,…
2.2. Hotline tên những hợp chất hữu cơ (Danh pháp hữu cơ)
2.2.1. Thương hiệu gọi khối hệ thống theo danh pháp IUPACTên nơi bắt đầu - chức: thương hiệu phần nơi bắt đầu + thương hiệu phần định chức
Tên cố gắng thế: thương hiệu phần ráng + thương hiệu mạch C bao gồm + thương hiệu phần định chức
Để call tên một cách đúng đắn các hợp hóa học hữu cơ, các em bắt buộc học thuộc phương pháp gọi tên những số đếm và tên mạch C chính.
Số đếm | Tên | Mạch Cacbon chính | Tên |
1 | mono | C | Met |
2 | di | C - C | Et |
3 | tri | C - C - C | Prop |
4 | tetra | C - C - C - C | But |
5 | penta | C - C - C - C - C | Pent |
6 | hexa | C - C - C - C - C - C | Hex |
7 | hepta | C - C -C - C - C - C - C | Hep |
8 | octa | C - C - C - C - C - C - C - C | Oct |
9 | nona | C - C - C - C - C - C - C - C - C | Non |
10 | deca | C - C - C -C - C - C - C - C - C - C | Dec |
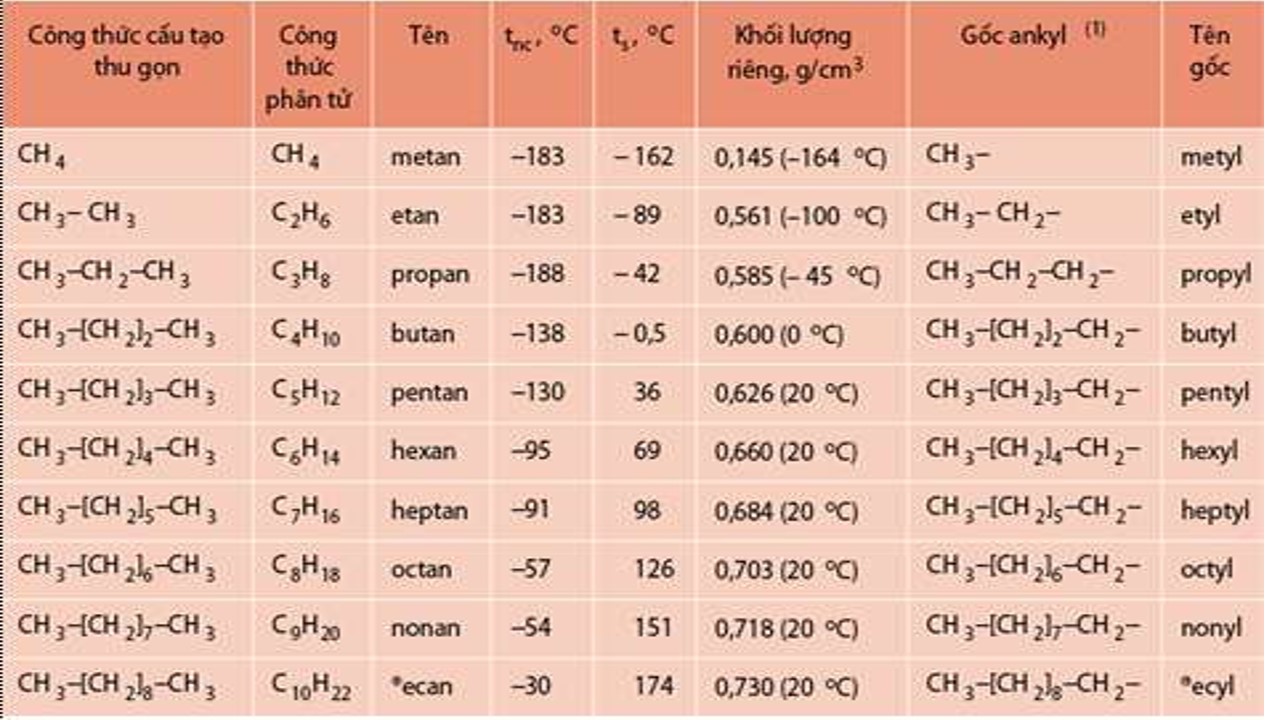
Tên những gốc Hidrocacbon đề xuất biết:
Tên nơi bắt đầu = thương hiệu mạch cacbon + “yl”
Ví dụ: CH3 – : metyl, C2H5 -: etyl
Các gốc riêng:
Ví dụ:
CH2 = CH - : vinyl
CH2 = CH - CH2 – : anlyl
2.2.2. Tên thường gọi thông thườngTên thường thì của những hợp hóa học hữu cơ thường xuyên được đặt theo xuất phát tìm ra chúng, một số rất có thể có phần đuôi để chứng thực hợp hóa học thuộc nhiều loại nào.Ví dụ :
HCOOH: axit fomic (formica ⇔ Kiến).
CH3COOH: axit axetic (acetus ⇔ Giấm).
C10H20O: mentol (mentha piperita ⇔ bội nghĩa hà).
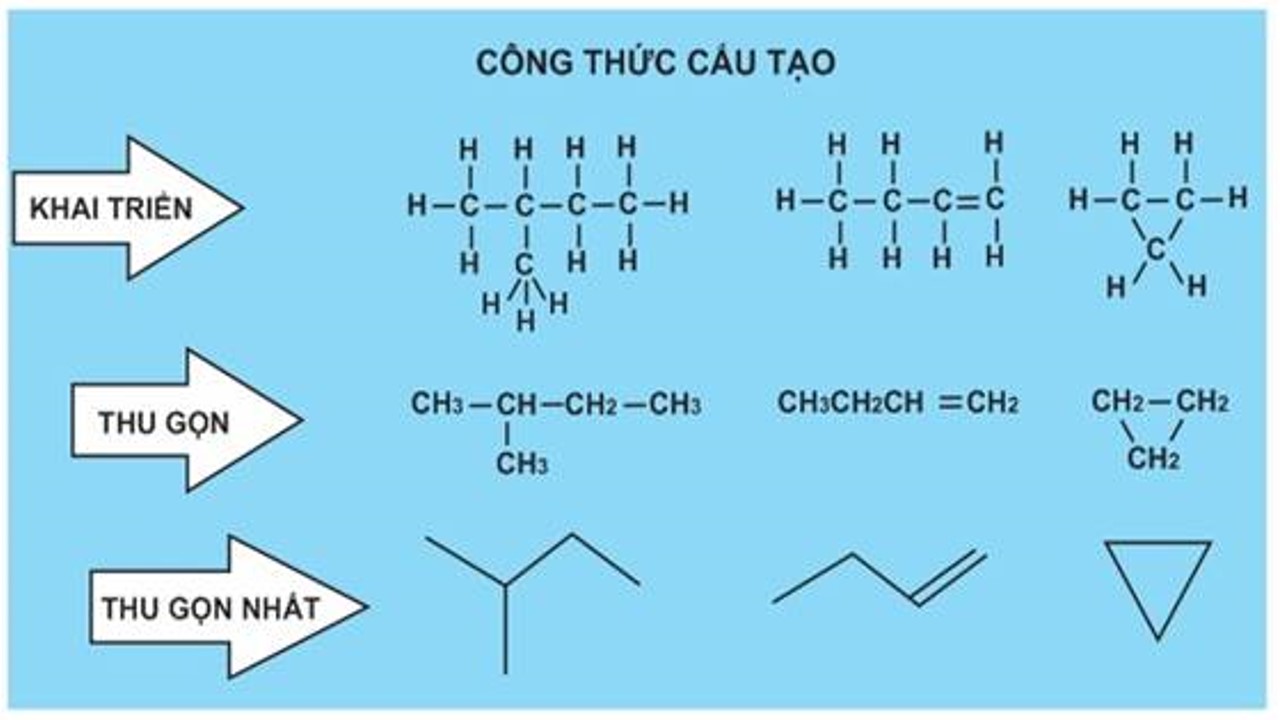
3. Phương pháp phân tử hợp hóa học hữu cơ
3.1. Công thức tổng thể (CTTQ)
Cho biết tin tức về các nguyên tố gồm trong phân tử hợp hóa học hữu cơ.
Ví dụ: ứng cùng với công thức tổng quát Cx
Hy
Oz
Nt, ta biết hợp hóa học hữu cơ này được cấu trúc từ các nguyên tố C, H, O và N.
3.2. Công thức đơn giản nhất (CTĐGN)
3.2.1. Định nghĩaCông thức đơn giản và dễ dàng nhất là phương pháp thể hiện tỉ lệ buổi tối giản về số nguyên tử của những nguyên tố trong phân tử.
3.2.2. Cách tùy chỉnh thiết lập công thức đơn giản dễ dàng nhấtThiết lập công thức đơn giản nhất của HCHC Cx
Hy
Oz
Nt nghĩa là tùy chỉnh cấu hình tỉ lệ:
x : y : z : t = (m
C/12) : (m
H/1) : (m
O/16) : (m
N/14)
x : y : z : t = (%m
C/12) : (%m
H/1) : (%m
O/16) : (%m
N/14)
Công thức thực nghiệm = (CTĐGN)n (trong kia n: số nguyên dương với CTĐGN: Công thức đơn giản và dễ dàng nhất). Xác minh n để tìm CTTN
3.3. Phương pháp phân tử
3.3.1. Định nghĩaCông thức phân tử là bí quyết thể hiện số lượng nguyên tử của mỗi nguyên tố trong kết cấu phân tử của nó.
3.3.2. Cách thiết lập công thức phân tửCó ba cách để thiết lập bí quyết phân tử
Cách 1: phụ thuộc vào thành phần % khối lượng các nguyên tố
Cho phương pháp phân tử Cx
Hy
Oz, ta bao gồm tỉ lệ:
M/100 = 12.x/(%m
C) = 1.y/(%m
H) = 16.z/(%m
O)
Từ kia ta có :
x = M.%m
C/(12.100);
y = M.%m
H/(1.100);
z = M.%m
O/(16.100);
Cách 2: dựa vào CTĐGN (công thức dễ dàng nhất).
Bước 1: Đặt bí quyết phân tử (CTPT) của hợp hóa học hữu cơ là: (CTĐGN)n (với n ∈ N)Bước 2: Tính độ bất bão hòa (k) của phân tử (chỉ vận dụng cho hợp chất hữu cơ có chứa links cộng hóa trị, không áp dụng cho hợp hóa học có links ion).Bước 3: dựa vào biểu thức k để chọn giá trị n, từ đó tìm ra CTPT (công thức phân tử) của hợp hóa học hữu cơ.
Giả sử một hợp hóa học hữu cơ gồm CTPT (công thức phân tử) là Cx
Hy
Oz
Nt thì tổng số link $pi$ và vòng của phân tử được điện thoại tư vấn là độ bất bão hòa của phân tử đó.
Công thức tính độ bất bão hòa (k).
k = (2x+2+t-y)/2 (k: tổng số link $pi$ và vòng)
y = 2x+2+t-2k
Cách 3: Tính thẳng theo cân nặng của thành phầm cháy
Phương trình phản bội ứng cháy: Cx
Hy
Oz
Nt + (x+y/4–z/2) O2 → x
CO2 + (y/2)H2O + (t/2)N2
Áp dụng định điều khoản bảo toàn nguyên tố: n
C= n
CO2; n
H= 2.n
H2O; n
N= 2.n
N2
Áp dụng định khí cụ bảo toàn khối lượng: m
HCHC = m
C + m
H + m
O + m
N + … = mtổng khối lượng các nguyên tố
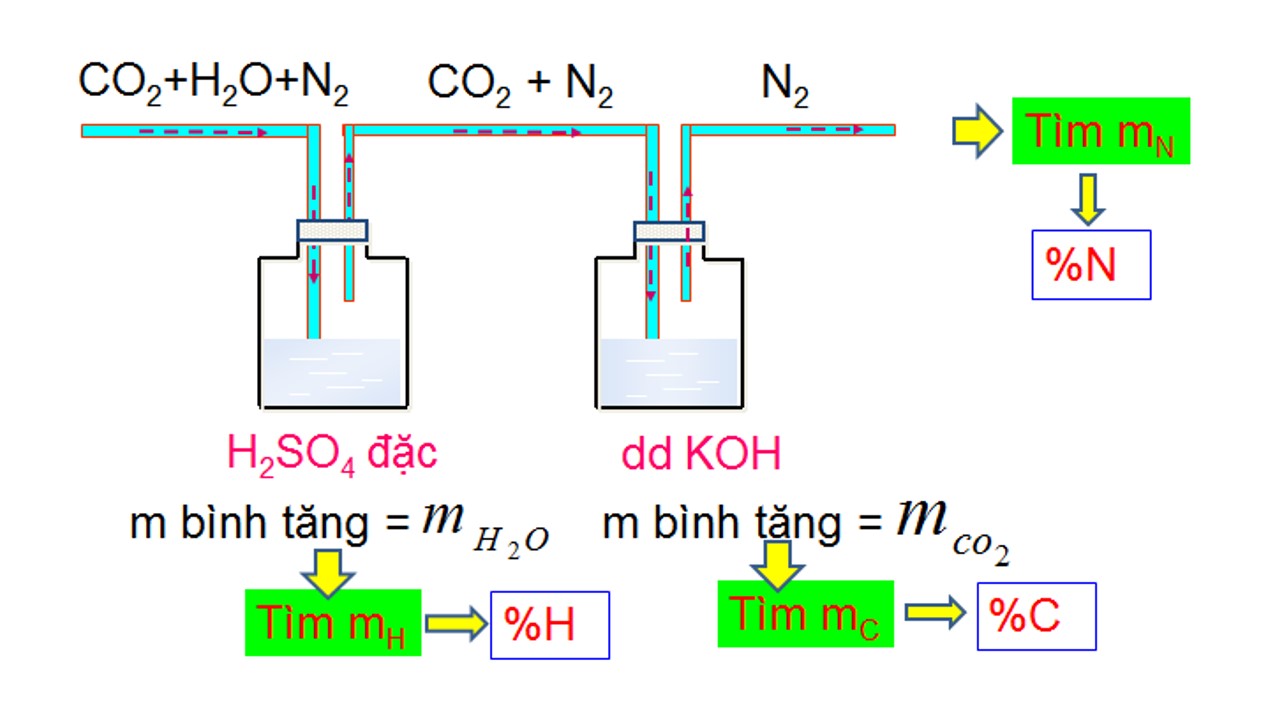
Sản phẩm cháy của hợp hóa học hữu cơ như CO2, H2O,... được hấp phụ vào các bình:
Sản phẩm là những chất hút nước là H2SO4 đặc, P2O5, các muối khan → cân nặng bình tăng chính là khối lượng nước;
Các bình hấp phụ CO2 thường xuyên là dung dịch bazơ → khối lượng bình tăng chính là trọng lượng CO2.
Thường chạm mặt trường hợp việc sẽ đến hỗn hợp sản phẩm cháy (CO2 và H2O) vào trong bình đựng nước vôi vào hoặc vào hỗn hợp Ba(OH)2 thì:
Khối lượng bình tăng: m↑ = m
CO2 + m
H2O
Khối lượng dung dịch tăng: mdd↑ = (m
CO2 + m
H2O) – mkết tủa
Khối lượng hỗn hợp giảm: mdd↓= mkết tủa – (m
CO2 + m
H2O)
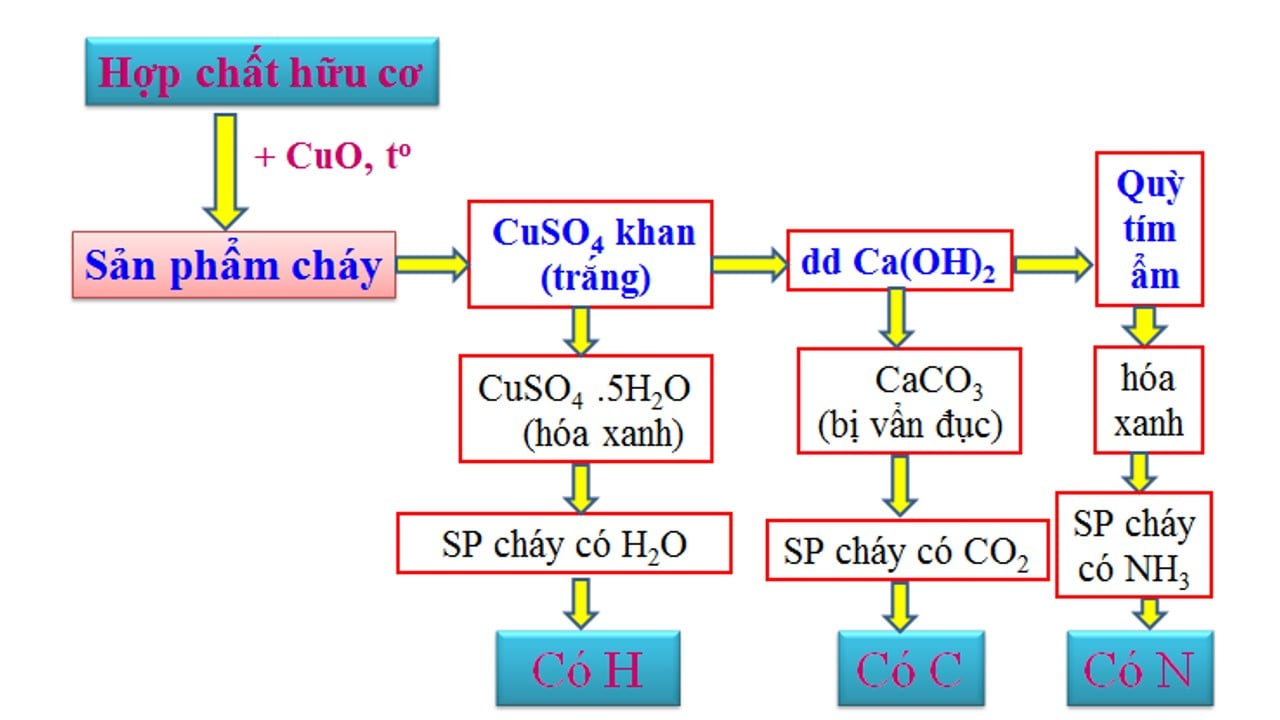
4. Phân tích nguyên tố vào hợp hóa học hữu cơ4.1. So với định tínhMục đích: khẳng định những nguyên tố nào xuất hiện trong nhân tố hợp chất hữu cơ.Nguyên tắc: Chuyển các nguyên tố có mặt trong hợp chất hữu cơ thành các chất vô cơ dễ dàng và đơn giản sau đó nhận ra chúng bằng những phản ứng đặc trưng.
4.2. So sánh định lượngMục đích: xác minh thành phần % về trọng lượng của những nguyên tố xuất hiện trong phân tử hợp chất hữu cơ.Nguyên tắc: Cân chính xác khối lượng của hợp hóa học hữu cơ. Kế tiếp chuyển yếu tắc C thành CO2, H thành H2O, N thành N2 rồi xác định chính xác khối lượng hoặc thể tích của những chất tạo ra thành. Từ đó tính được % khối lượng các nguyên tố.
Xác định trọng lượng mol phân tử:
+ phụ thuộc tỉ khối của hóa học hữu cơ so với không khí hoặc so với H2: MA = 29.d
A/KK hoặc MA = 2.d
A/H2
+ những chất khó cất cánh hơi hoặc không mờ hơi được khẳng định bằng phương thức nghiệm lạnh hoặc nghiệm sôi.
5. Hiện tượng kỳ lạ đồng đẳng cùng đồng phân
5.1. Đồng đẳng
Những hợp hóa học hữu cơ tất cả thành phần phân tử hơn nhát nhau một hay những nhóm CH2 tuy thế có tính chất hoá học tương tự như nhau được hotline là phần đông chất đồng đẳng cùng với nhau, chúng hợp thành hàng đồng đẳng.
Giải thích: tuy vậy các hóa học trong thuộc dãy đồng đẳng gồm công thức phân tử (CTPT) không giống nhau về số lượng nhóm CH2 nhưng vày chúng có cấu tạo hoá học tựa như nhau đề xuất có đặc điểm hoá học cũng như nhau.
Ví dụ: các hiđrocacbon vào dãy: CH4, C2H6, C3H8, C4H10, C5H12,…Cn
H2n+2, chất phía sau hơn chất liền trước 1 team CH2 và đều sở hữu tính hóa học hoá học tương tự như nhau.
5.2. Đồng phân
Những hợp chất có cấu tạo khác nhau nhưng tất cả chung phương pháp phân tử hotline là đầy đủ chất đồng phân.
Giải thích: số đông chất đồng phân là phần nhiều chất tất cả cùng cách làm phân tử dẫu vậy có cấu trúc hoá học lại khác nhau, chẳng hạn etanol có cấu tạo H3C-CH2-OH, còn đimetyl ete có cấu trúc H3C-O-CH3, bởi vì vậy tuy nhiên công thức phân tử như là nhau nhưng bọn chúng là đa số chất khác nhau, có tính chất khác nhau.
→ Etanol (C2H5OH) với đimetyl ete (CH3OCH3) là 2 chất trọn vẹn khác nhau (tính chất khác nhau) nhưng lại có chung bí quyết phân tử là C2H6O.
6. Links hóa học và các phản ứng hóa hữu cơ
6.1. Link hóa học
6.1.1. Links σLiên kết tạo bởi 1 cặp electron dùng thông thường được call là link đơn. Link đơn này nằm trong loại liên kết σ. Link đơn giữa 2 nguyên tử được màn biểu diễn bằng 2 vết chấm hoặc 1 gạch men nối.
6.1.2. Liên kết $pi$Liên kết tạo bởi vì 2 cặp electron dùng phổ biến được điện thoại tư vấn là liên kết đôi. Link đôi này bao gồm 1 liên kết σ với 1 links $pi$, trình diễn bằng 4 vệt chấm hoặc 2 gạch ốp nối thân 2 nguyên tử.
Liên kết tạo do 3 cặp electron dùng phổ biến được điện thoại tư vấn là liên kết ba. Links ba này gồm 1 liên kết σ cùng 2 link $pi$, màn biểu diễn bằng 6 lốt chấm hoặc 3 gạch men nối giữa 2 nguyên tử.
Liên kết đôi và liên kết ba call là links bội.
6.2. Phản bội ứng hóa hữu cơ
6.2.1. Liên kết σĐây là links bền nhất trong số loại liên kết cấu trúc nên hợp hóa học hữu cơ .
Là liên kết tạo thành căn nguyên chính đến mạch cacbon.
Nếu không tồn tại liên kết σ giữa hai nguyên tử thì cần thiết hình thành link $pi$ giữa hai nguyên tử đó.
a. Bội phản ứng cố kỉnh bẻ gãy links C-H:
Bậc của Cacbon: những Cacbon vào mạch C bao gồm bậc tương ứng với số Cacbon mà nó link trực tiếp xung quanh.
Quy tắc bội phản ứng thế:
Khi link C-H bị bẻ gãy thì theo thiết bị tự ưu tiên C-H của C bậc cao đã dễ bị gãy hơn.
Phản ứng nuốm của C-H xẩy ra ở bất kỳ liên kết C-H như thế nào trong phân tử hợp chất hữu cơ không chứa liên kết $pi$ của C với C.
Tạo ra nhiều thành phầm thế:
Sản phẩm chính: sản phẩm thế vào địa chỉ C bậc cao nhất.
Sản phẩm phụ: là thành phầm thế vào các vị trí C còn lại.
Phương trình chất hóa học tổng quát:
Cn
H2n+2 + Cl2 -askt→ Cn
H2n+1Cl + HCl
Cn
H2n+1Cl : là các chất (đồng phân) bao hàm sản phẩm thiết yếu lẫn sản phẩm phụ.
b. Bội phản ứng cracking bẻ gãy link C-C:
Đây là phản ứng bẻ gãy mạch Cacbon khó xẩy ra nên cần ánh sáng (to), xúc tác (xt), áp suất (p) độc nhất vô nhị định.
Phản ứng chỉ xẩy ra ở hợp hóa học Ankan (hidrocacbon mạch hở ko chứa link $pi$)
Phản ứng bẻ gãy chế tác ra thành phầm là 1 ankan và 1 anken:
Phương trình hóa học tổng quát:
Cn
H2n+2 –cracking→ Ca
H2a+2 + Cb
H2b
n = a + b.
1 mol ankan cracking tạo nên 2 mol sản phẩm (1 mol ankan + 1 mol anken).
6.2.2 links $pi$a. Bội nghịch ứng cùng vào link $pi$:
Trong link C = C có 1 liên kết $pi$ vào C ≡ C có 2 link $pi$ đều thuận tiện bị bẻ gãy để chế tạo thành các liên kết σ bền chắc hơn.
Ví dụ :
CH2 = CH2 + Br2 → CH2Br – CH2Br
Nhận xét :
Liên kết $pi$ giữa 2 Cacbon bị bẻ gãy để chế tạo ra thành 2 liên kết σ C-Br bền chắc hơn.
Một $pi$ bội phản ứng với 1 Br2.
Khi cùng vào yếu tắc bất đối xứng như HX ( H2O, HCl,…) yếu tố X được ưu tiên tích hợp vị trí C bậc cao.
Sản phẩm chính: lúc X đã tích hợp vị trí C bậc cao.
Sản phẩm phụ: lúc X gắn vào các vị trí C còn lại.
Ví dụ :
CH2 = CH - CH3 + HCl → CH3 - CHCl - CH3 (sản phẩm chính)
CH2 = CH - CH3 + HCl → CH2Cl - CH2 - CH3 (sản phẩm phụ)
b. Bội phản ứng trùng thích hợp – liên kết $pi$:
Là bội nghịch ứng bẻ gãy links $pi$để tạo nên liên kết σ kết nối các phân tử monome chế tác thành phân tử to hơn (đime, trime,… polime)
Ví dụ :
dime: 2 CH ≡ CH (axetilen) → CH ≡ C - CH = CH2 (nhiệt độ, xúc tác, áp suất) (vinyl axetilen)
n CH2 = CHCl (vinyl clorua) → ( CH2-CHCl ) n (poli vinyl clorua hay nói một cách khác là P.V.C)
c. Phản ứng cầm cố của H linh động:
Xét hợp chất R - C ≡ CH : H trong trường phù hợp này là H biến hóa năng động có khả năng tạo bội phản ứng núm với:
Kim loại mạnh bạo giải phóng H2.
Ag
NO3/NH3 tạo kết tủa muối hạt Ag.
Ví dụ :
R - C ≡ CH + mãng cầu → R - C ≡ CNa + H2
R - C ≡ CH + Ag2O → R - C ≡ CAg (kết tủa) + H2O (Ag2O là yếu tố tượng trưng đến dd Ag
NO3/NH3)
7. Lý thuyết hóa hữu cơ: Hiđrocacbon
7.1. Ankan
Dãy đồng đẳng ankan (parafin): Công thức bao quát (CTTQ): Cn
H2n + 2 (n ≥ 1).
Ví dụ: CH4, C2H6, C3H8, C4H10, C5H12,....
Đồng phân:
Chỉ bao gồm đồng phân mạch C (dạng mạch thẳng, mạch nhánh).
Cách viết đồng phân:
Viết mạch C thẳng. Ta được đồng phân thứ nhất mạch thẳng.
Giảm 1 C làm nhánh, xét tính đối xứng của mạch để gắn C vào nhánh, đến khi số C có tác dụng nhánh bởi với số C của mạch bao gồm thì ngừng lại.
Xem thêm: Việc làm siêu thị vinmart tuyển dụng 20/01/2023, việc làm siêu thị vinmart
Bổ sung thêm các nguyên tử H nhằm thu được đồng phân hoàn chỉnh.
Công thức tính nhanh của ankan: 3
Danh pháp:
Chọn mạch chính: là mạch dài nhất, nhiều nhánh nhất.
Đánh số: C số 1 được quy cầu là C ngay gần mạch nhánh nhất.
Tên: Số chỉ địa chỉ nhánh – thương hiệu nhánh + tên mạch chính + an.
Bậc C: số nguyên tử C mà liên kết với C sẽ xét: C bậc 1 liên kết với 1 C xung quanh; C bậc 2 liên kết với 2 C xung quanh; C bậc 3 links với 3 C xung quanh.
Tính chất vật lý
Nhẹ rộng nước và gần như không tung trong nước, chảy nhiều trong các dung môi hữu cơ.
Trong đk thường, C1 → C4 ở dạng khí, những ankan tiếp sau (C5 → C17) sinh sống dạng lỏng, C18 trở đi nghỉ ngơi dạng rắn.
Đặc điểm: Chỉ gồm những liên kết đơn.
Tính chất hóa học
Phản ứng thế là 1 phản ứng đặc thù của ankan. Nguyên tử H (ưu tiên H ở C bậc cao) vào ankan bị sửa chữa thay thế bởi thành phần halogen trong đk có tia nắng hoặc đun nóng.
Phản ứng tách: Dưới nhiệt độ và xúc tác ưa thích hợp, ankan gồm phân tử khối bé dại bị bóc tách thành những anken tương ứng.
Ứng dụng của Ankan
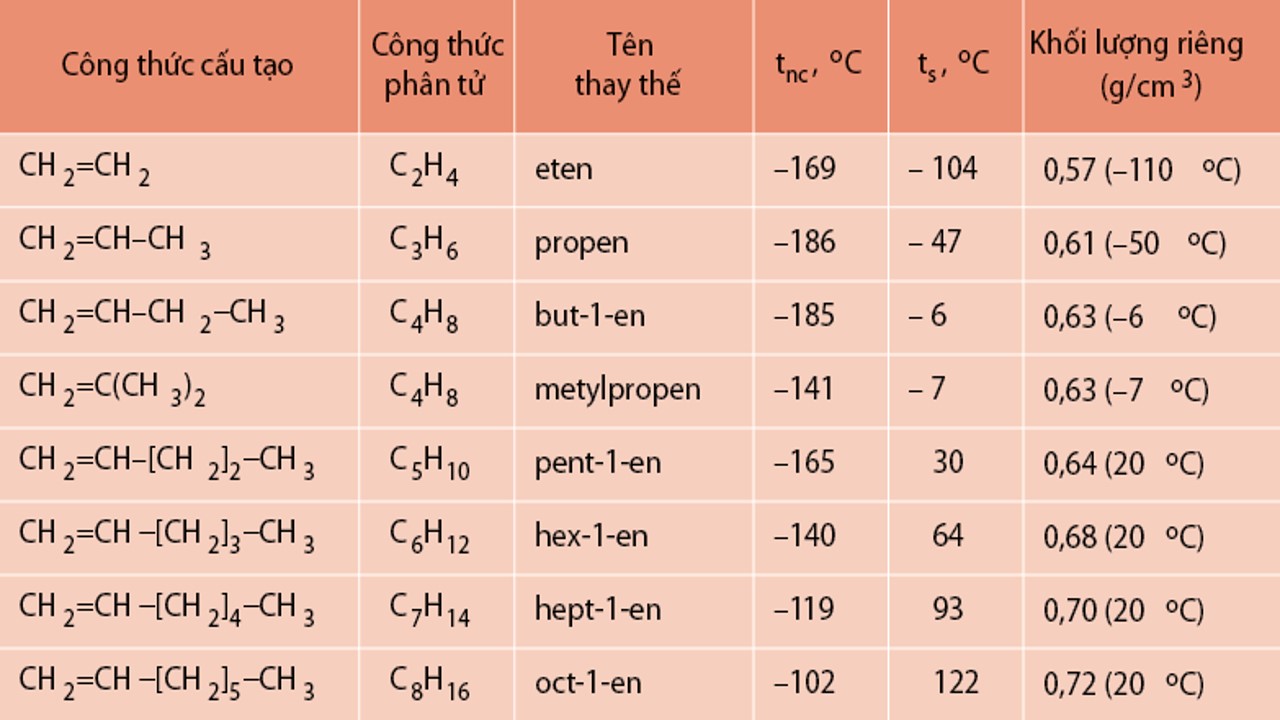
7.2. Anken
Dãy đồng đẳng anken (olefin): Công thức tổng thể là Cn
H2n (n ≥ 2).
Đồng phân: Anken tất cả 2 nhiều loại đồng phân là đồng phân kết cấu (mạch C với vị trí nối đôi) và đồng phân hình học.
Đồng phân cấu tạo:
Cách viết đồng phân: Viết mạch C thẳng. Xét tính đối xứng để đặt vị trí link đôi phù hợp. Ta thu được những đồng phân mạch thẳng.
Tách 1 C ra làm cho nhánh, xét tính đối xứng để gắn C nhánh với vị trí nối đôi, soát sổ hoá trị của C. Tiếp tục viết những vị trí nhánh khác nhau đến khi số C có tác dụng nhánh bởi với số C của mạch thiết yếu thì giới hạn lại.
Bổ sung thêm các nguyên tử H nhằm thu được đồng phân hoàn chỉnh.
Khi 2 nhóm cố gắng của nguyên tử C sở hữu nối đôi không giống nhau thì vẫn làm lộ diện đồng phân hình học. Nếu các nhóm thay (-CH3, -C2H5, -Cl,...) tất cả phân tử khối lớn hơn nằm cùng về một hướng với nối đôi đã thu được đồng phân dạng cis. Nếu các nhóm thế gồm phân tử khối lớn hơn nằm khác phía đã thu được đồng phân dạng trans.
Danh pháp:
Chọn mạch chính: là mạch C nhiều năm nhất, tất cả chứa nối đôi và nhiều nhánh nhất.
Đánh số: C số 1 tính tự C gần địa điểm nối song nhất.
Tên: Số chỉ địa điểm nhánh – tên nhánh + tên mạch thiết yếu – số chỉ địa điểm nối đôi – en.
Đặc điểm cấu tạo: mạch hidocacbon phải có một links đôi, trong các số đó có một link π cùng một liên kết σ.
Tính chất vật lí:
Nhẹ rộng nước, không tan trong nước.
Trong đk thường, C2 → C4 tồn tại sinh hoạt dạng khí, C5 trở đi tồn tại nghỉ ngơi dạng lỏng hoặc rắn.
Khi phân tử khối (M) tăng, ánh nắng mặt trời nóng chảy, ánh nắng mặt trời sôi và trọng lượng riêng cũng biến thành tăng theo.
Tính chất hoá học của anken:
Phản ứng đặc trưng là phản nghịch ứng cộng (vì có link π dễ dẫn đến phá huỷ, hèn bền):
Anken nếu cộng H2 sẽ xuất hiện ankan tương ứng; nếu cùng với halogen tốt hợp hóa học halogen sẽ hiện ra dẫn xuất của halogen; nếu cộng với nước sẽ hiện ra ancol tương ứng.
Quy tắc Maccopnhicop: khi Anken cộng với những hợp chất không đối xứng HX (HCl, HBr, H2O), H ưu tiên đã nhập vào vị trí C bậc thấp, còn X ưu tiên tích hợp vị trí C bậc cao.
- làm phản ứng trùng hợp
- phản nghịch ứng oxy hóa
- bội phản ứng làm mất đi màu dung dịch KMn
O4 với mất màu dung dịch brom là 2 phản nghịch ứng đặc trưng dùng để làm nhận biết anken.Ứng dụng của anken:
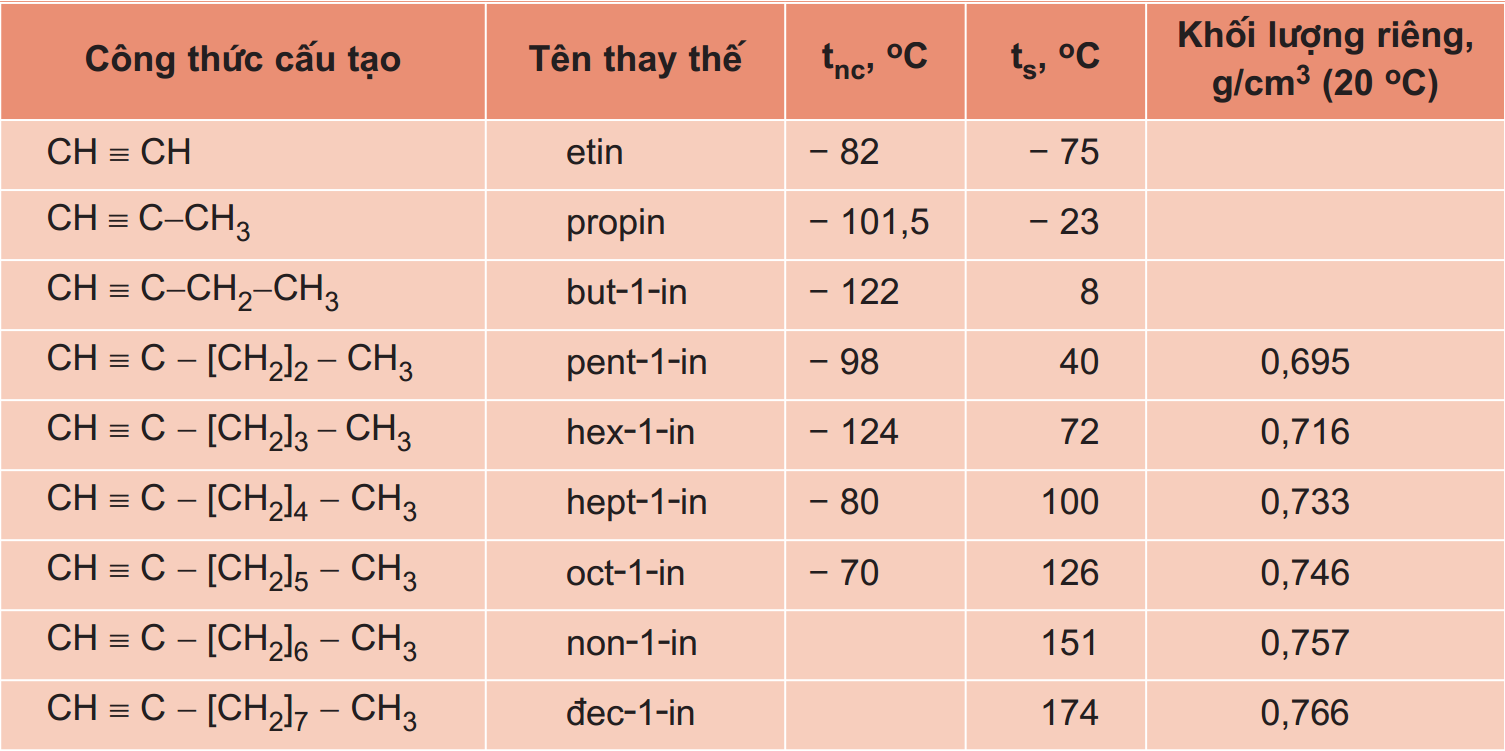
7.3. Ankin
Ankin là các hiđrocacbon mạch hở mà trong phân tử có chứa một nối ba.
Công thức tổng quát: Cn
H2n - 2 ( n ≥ 2).
Đồng phân: Ankin tất cả đồng phân mạch C cùng đồng phân vị trí nối ba, ankin không có đồng phân hình học. Giải pháp viết đồng phân:
Viết mạch C thẳng. Xét tính đối xứng của mạch C để đặt vị trí link ba. Ta thu được đồng phân mạch thẳng.
Tách 1 C làm cho nhánh, xét tính đối xứng để gắn C nhánh và vị trí nối ba, bình chọn hoá trị của C. Liên tiếp viết những vị trí nhánh khác nhau đến lúc số C ở làm cho nhánh bằng với số C của mạch thiết yếu thì dừng lại.
Bổ sung thêm các nguyên tử H để thu được đồng phân trả chỉnh.
Danh pháp:
Gọi tên
Chọn mạch chính: là mạch C dài nhất, bao gồm chứa nối cha và những nhánh nhất.
Đánh số:C hàng đầu tính tự C gần vị trí nối bố nhất.
Tên: Số chỉ vị trí nhánh – thương hiệu nhánh + tên mạch chính – số chỉ địa chỉ nối tía – in.
Tên gọi thường:
Ví dụ:
CH ☰ CH: axetilen
CH ☰ C - CH3: metylaxetilen
CH ☰ C - CH2 - CH3: etylaxetilen
CH3 - C ☰ C - CH3: dimetylaxetilen
Tính chất hóa học:
Phản ứng cộng
Phản ứng nhị hợp, tam vừa lòng của axetilen
Phản ứng thế: nhận thấy ank - 1 - in
Phản ứng oxy hóa
Ứng dụng của Ankin:
7.4. Ankađien
Ankađien là các hidrocacbon mạch hở mà lại trong phân tử gồm chứa 2 nối đôi.
Công thức tổng quát: Cn
H2n - 2 (n ≥ 3)
Phân loại:
Ankađien gồm 2 nối đôi tiếp tục nhau
Ankađien có 2 nối đôi bí quyết một nối đối chọi (hay nói một cách khác là ankađien liên hợp, ankadien nhiều loại này được áp dụng nhiều nhất)
Ankađien gồm 2 nối đôi bí quyết nhau những nối đơn,....
Tính hóa học hoá học: Ankađien có các tính chất hoá học giống như như anken.
Ứng dụng của ankadien: điều chế các polime tất cả tính bầy hồi cao dùng trong cung cấp cao su.
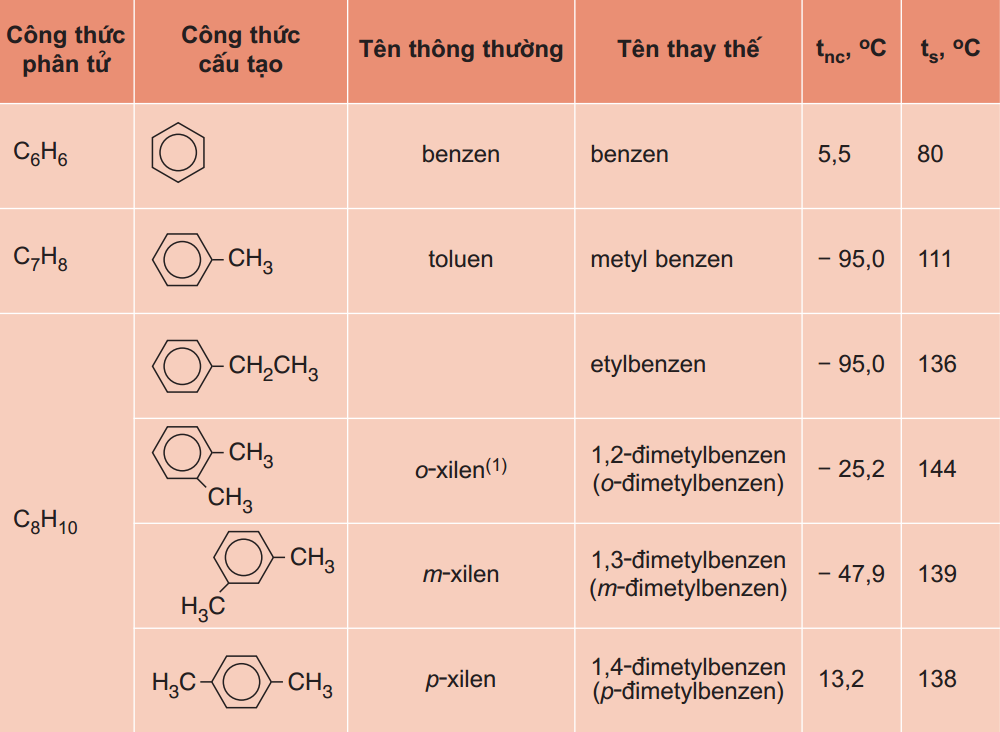
7.5. Hàng đồng đẳng benzen
Đồng đẳng benzen là các hiđrocacbon thơm nhưng mà trong phân tử cất một vòng benzen.
Công thức tổng quát: Cn
H2n-6 (n ≥ 6).
Công thức tính đồng phân: (n - 6)2 (7 ≤ n ≤ 9)
Viết đồng phân: Đồng đẳng benzen có đồng phân về vị trí nhóm ankyl trên vòng và kết cấu mạch C của nhánh.
Vòng benzen được quy ước luôn luôn là mạch chính.
6 địa điểm C trên vòng benzen chính là 6 vị trí để gắn nhánh.
Nếu số C của nhánh từ 3 trở lên sẽ có được đồng phân kết cấu mạch C của nhánh.
Tên gọi: Tên nhóm ankyl + benzen.
Đánh số thế nào cho chỉ số nhánh là nhỏ dại nhất.
Nếu 2 nhóm thế ở phần 1 và 2 với nhau, ta điện thoại tư vấn là ortho- (o-).
Nếu 2 team thế tại phần 1 cùng 3 với nhau, ta call là meta- (m-).
Nếu 2 đội thế ở phần 1 với 4 cùng với nhau, ta gọi là para- (p-)
Đặc điểm cấu tạo: Vòng benzen bền bỉ theo năm tháng vững vì bao gồm 3 link đơn xen kẽ giữa 3 liên kết đôi.
Tính chất hoá học:
Phản ứng thế:
Khi gồm xúc tác Fe, ánh nắng mặt trời sẽ xảy ra phản ứng gắng vào nhân thơm.
Khi bao gồm ánh sáng, ánh sáng sẽ xảy ra phản ứng cầm cố vào địa chỉ nhánh.
Quy tắc cố kỉnh vào nhân benzen:
Khi vòng benzen đã gồm sẵn nhóm nắm ankyl thì các nhóm thế tiếp sau ưu tiên cầm cố vào địa chỉ ortho cùng para (2, 4, 6).
Khi vòng benzen đã có sẵn nhóm nuốm COOH, nơi bắt đầu R chứa links đôi, NO2, team thế tiếp sau được ưu tiên nạm vào những vị trí meta (3, 5).
Phản ứng oxy hóa
Oxy hóa không trả toàn: benzen cùng toluen không làm mất đi màu KMn
O4 trong đk thường nhưng mà khi đun nóng cách thủy, toluen tạo thành kết tủa Mn
O2 và làm mất đi màu Kmn
O4.
Ứng dụng của benzen:
I. Tổng hợp triết lý hoá hữu cơ: Đại cưng cửng hoá hữu cơII. Tổng hợp lý thuyết hoá hữu cơ: Hiđrocacbon
Phần hoá hữu cơ luôn là phần gây khó khăn nhất cho các em trong việc hiểu và ghi nhớ loài kiến thức. Chính vì như vậy Kiến Guru vẫn biên soạn bài Tổng hợp lý thuyết hoá hữu cơ một phương pháp đầy đủ, dễ nhớ nhất về hiđrocacbon để cung ứng các em.
I. Tổng hợp triết lý hoá hữu cơ: Đại cương hoá hữu cơ
1. Đặc điểm, phân loại:
– Định nghĩa: Hợp chất hữu cơ là hợp hóa học của cacbon trừ những hợp chất đơn giản dễ dàng như CO, CO2, những muối cacbonat, các hợp chất xianua.
– Đặc điểm:
+ Phải gồm cacbon, thường có hiđro, hay gặp mặt oxi với nitơ, kế tiếp đến những halogen, lưu huỳnh, photpho…
+ liên kết hoá học chủ yếu: cộng hoá trị.
+ Dễ cất cánh hơi, yếu bền nhiệt, dễ cháy hơn những hợp hóa học vô cơ.
+ những phản ứng thường diễn ra chậm với không trả toàn, không áp theo một hướng nhất định.
+ con số các hợp hóa học hữu cơ khoảng 10 triệu chất, so với những chất vô cơ chỉ có khoảng 100.000 chất.
– Phân loại:
+ Hiđrocacbon: hiđrocacbon no (chỉ có links đơn)
hiđrocacbon ko no (có cả link đơn và những liên kết đôi, ba)
hiđrocacbon thơm (trong phân tử có vòng benzen).
+ Dẫn xuất hiđrocacbon: ancol, phenol, ete
dẫn xuất halogen
anđehit – xeton
axit, este,…
– Thành phần yếu tố và công thức phân tử:
+ Công thức bao quát (CTTQ): cho thấy thêm thành phần định tính các nguyên tố.
Ví dụ: Cx
Hy
Oz cho thấy chất cơ học đó mang lại chứa cha nguyên tố C, H cùng O.
+ Công thức đơn giản dễ dàng nhất (CTĐGN): cho thấy tỷ lệ về con số các nguyên tử trong phân tử.
Ví dụ: CH2O nghĩa là trong phân tử, tỉ trọng C : H : O = 1: 2 :1.
+ bí quyết phân tử (CTPT): cho biết số lượng nguyên tử của từng nguyên tố vào phân tử.
Ví dụ: cùng với CTĐGN là CH2O thì CTPT là (CH2O)n khi n = 2 ta bao gồm C2H4O2.
Để xác định được cách làm phân tử cần biết thành phần những nguyên tố và trọng lượng mol phân tử của nó.
– đối chiếu định tính cùng định lượng những nguyên tố:



Tổng hợp lý thuyết hoá hữu cơ
Mong rằng với phần Tổng hợp triết lý hoá hữu cơ về hiđrocacbon bên trên đây sẽ giúp các em nắm vững kiến thức hoá hữu cơ và sẵn sàng tốt nhằm học các chương tiếp theo.









